
2022年9月28日,沛嘉医疗(9996.HK)与法国HighLife SAS公司合作独占的HighLife经导管二尖瓣置换系统(以下简称HighLife TSMVR)通过了国家药品监督管理局(NMPA)的创新医疗器械特别审批申请(“绿色通道”)。
HighLife TSMVR是继TaurusOne、TaurusElite、TaurusNXT三代经导管主动脉瓣置换产品之后,沛嘉医疗在结构性心脏病领域内又一个进入创新医疗特别审批“绿色通道”的创新产品,布局二尖瓣介入治疗领域。本次通过创新医疗特别审批的沛嘉医疗HighLife TSMVR产品是国内首款进入临床的经股静脉房间隔穿刺入路的二尖瓣置换系统,该技术亦是国际领先的二尖瓣置换介入治疗方案。HighLife TSMVR技术在TCT、PCR等国际会议上公开的可行性临床试验中期数据,证实了该技术较现有治疗方式,可能实现更微创伤的二尖瓣置换。
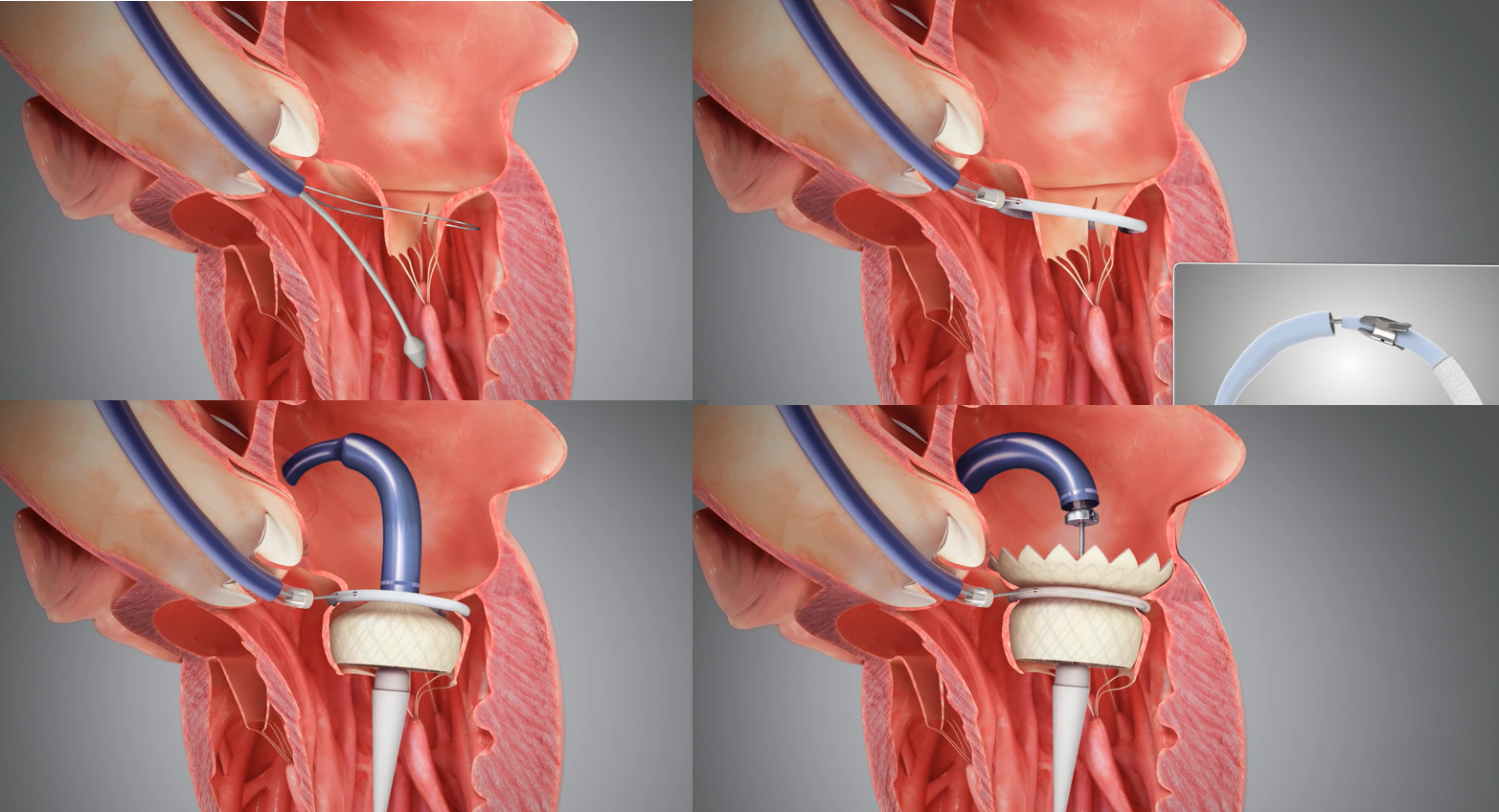
HighLife TSMVR系统运用“Valve-in-Ring”的概念,巧妙地经主动脉路径在二尖瓣腱索周围预置一个环形结构作为锚定物,然后再由经股经房间隔入路,植入自膨式牛心包瓣膜。通过两个植入物的相互锁定,形成非假体径向支撑力为基础的锚定,这种锚定方式既可以以单一规格尺寸适应广泛解剖结构,又避免了对原生结构的损伤,同时形成有效封堵,避免瓣周漏。HighLife TSMVR瓣膜释放过程中无需旋转定位或考虑同轴性,释放过程中即可实现自适应、自同轴。其经房间隔的输送系统仅30Fr外径尺寸,有效降低了相应血管并发症的发生。根据目前公开的早期临床数据,HighLife TSMVR对于中重度及重度二尖瓣返流的患者,即刻二尖瓣返流改善明显,血管并发症概率较低,增强了真正微创介入治疗二尖瓣疾病的信心。
创新医疗器械特别审查程序适用于申请人通过其主导的技术创新活动,在中国依法拥有产品核心技术发明专利权;申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源;产品主要工作原理或作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并具有显著临床应用价值。创新医疗器械特别审查程序对创新医疗器械注册申报予以优先办理,HighLife TSMVR将获得注册材料的优先审查权,在注册检测,产品受理,技术审评和行政审批流程中都享有加速优待,加快产品上市速度,目前HighLife TSMVR即将开启NMPA上市前多中心临床试验,在保证安全、有效的前提下,更早为患者带来更好的临床解决方案,惠及我国更多二尖瓣返流的患者。
沛嘉医疗于2012年成立,总部位于中国江苏苏州,2020年5月在港交所上市(股票代码09996.HK)。公司秉持“至善尽心,敬畏生命”的理念,始终将生命和安全放在首位,深耕技术,坚持创新,竭尽所能助力生命健康。公司定位“创新为本,心脑同治”战略布局,专注于创新、研发及生产结构性心脏病和脑血管介入领域高端医疗器械,涵盖主动脉瓣、二尖瓣、三尖瓣及手术附件,脑血管介入出血类、缺血类、通路类产品,构建起国内结构性心脏病和脑血管介入领域较为全面的产品组合及解决方案。